La importancia de la verificación de kits de diagnóstico
Un diagnostico nos ayuda a comprender qué tipo de enfermedad o patología se presenta, y con ello una guía para aplicar un tratamiento que mejorará la calidad de vida del paciente.
Por Q. F. I. Lesly Montserrat Martínez Manzano

Una primera señal de una enfermedad puede detectarse través de la sintomatología, no obstante, existen pruebas sencillas y económicas que permiten dar un diagnostico rápido sobre alguna enfermedad o afección, las cuales para un diagnostico definitivo o con una mayor seguridad, se confirman a través de técnicas más complejas o con un mayor alcance.
La pruebas de diagnostico, se fundamentan principalmente en la afinidad antígeno-anticuerpo, de forma que si disponemos de anticuerpos específicos podemos detectar los antígenos correspondientes en una muestra clínica. Los anticuerpos específicos son obtenidos como antisueros de animales inmunizados conocidos como anticuerpos policlonales, o por producción In Vitro como los anticuerpos monoclonales, estos últimos presentan un alto grado de especificidad, que los hace muy útiles para distinguir entre microorganismos muy próximos antigénicamente.1
Las pruebas de diagnóstico rápido nos permiten disponer de un resultado en tiempo real, es decir, al mismo tiempo o poco después de examinar al paciente; de esta manera facilitan el diagnostico etiológico de los procesos infecciosos en general.1
Los fabricantes de las pruebas diagnostico comerciales deben registrar sus productos, los cuales deben cumplir con una serie de requisitos ante la autoridad de salud del país donde se plantea ser puesto al mercado, entre los cuales se encuentra la descripción detallada de la técnica, de los reactivos y componentes del kit, presentación, incompatibilidades, efectos secundarios e interacciones; información de su proceso de producción, controles de calidad, así como validación del método de prueba, el cual es realizado por el fabricante y cuando este se busca reproducir o transferir a otro laboratorio, el laboratorio receptor únicamente realiza una verificación de los parámetros que el fabricante delimitó durante su proceso de validación.
La validación ha sido objeto de atención por ser requerida en normas sobre sistemas de gestión de la calidad, sobre software y particularmente en la norma ISO 17025 sobre requisitos generales para laboratorios de calibración y ensayo. De acuerdo a la ISO 9000:2000 la validación es la confirmación y provisión de evidencia objetiva de que se cumplen los requisitos para un uso o aplicación prevista. Mientras que para la ISO 17025 la validación se define como la confirmación por examen y la provisión de evidencia objetiva de que se cumplen los requisitos particulares para un uso específico propuesto. Con base en esta información se sabe que es de gran importancia demostrar que un método cumple con el objetivo con el que fue propuesto mediante la validación o aplicabilidad del método ya sea fisicoquímico, químico, biológico, bioanalítico, microbiológico, etc.2
En el área clínica esta evidencia experimental y documental que se genera del método se conoce como verificación, esto a diferencia de otras técnicas analíticas, se distingue, en que los kits de diagnostico han sido validados y reportados por el propio fabricante, una vez que el fabricante lo ha validado y por consiguiente registrado, estos métodos se consideran métodos “normalizados”, por lo que otro laboratorio de control que desee reproducir la técnica procederá a garantizar el correcto funcionamiento de la técnica en las condiciones de su laboratorio. A las operaciones que se realicen para ello, se le denomina “Verificación del método”.
En la verificación del kit se estudian los parámetros de Sensibilidad analítica y diagnostica, Especificidad analítica y diagnostica, Repetibilidad, Linealidad o intervalo reportable y si es requerido (en caso de efectuar modificaciones al método de prueba declarado por el inserto o el fabricante) se realizan ensayos de Tolerancia y/o Robustez.
A continuación de manera breve se describe en qué consiste la evaluación de los parámetros enunciados anteriormente.
- Sensibilidad analítica: La sensibilidad analítica también es conocida como límite de detección (LD) el cual se define como la capacidad del ensayo para detectar bajas concentraciones de un analito en una muestra biológica.
- Sensibilidad diagnostica: Se define como la probabilidad de que el resultado de la prueba sea positivo en una persona afectada por la enfermedad. Representa la fracción de verdaderos positivos (ver Figura 1).
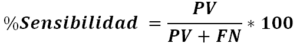
Figura 1. Cálculo del porcentaje de sensibilidad para el parámetro de Sensibilidad Diagnostica.
- Especificidad analítica: Se evalúa la capacidad del ensayo para detectar o cuantificar solamente el analito de interés sin que sea afectado por reactividad cruzada con otros anticuerpos o sustancias interferentes.
- Especificidad diagnostica: Se define como la probabilidad de que el resultado de la prueba sea negativo en una persona sana, que no padece la enfermedad. Por tanto, representa la fracción de verdaderos negativos. Así pues, la especificidad, expresada en tanto por ciento, representa el porcentaje de resultados negativos respecto del total de personas sanas, esto es, el porcentaje de verdaderos negativos obtenido al aplicar la prueba a personas sanas (ver Figura 2).
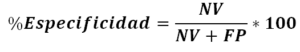
Figura 2. Cálculo del porcentaje de especificidad para el parámetro de Especificidad Diagnostica.
- Precisión (Repetibilidad): Al igual que en la validación de métodos analíticos, es importante conocer que las determinaciones realizadas por la prueba son repetibles y consistentes, por lo que como parte de la verificación de pruebas de diagnostico se determina el grado de concordancia entre los resultados de mediciones independientes en las condiciones establecidas.
- Linealidad: Cuando se trata de pruebas cuantitativas, es necesario realizar la verificación de la capacidad del método de prueba para obtener resultados directamente proporcionales a la concentración del analito en la muestra, para la cual se ha demostrado que el método tiene un nivel adecuado de precisión y exactitud.
Todos los parámetros anteriores, comúnmente son comparados con los reportados por el fabricante, esto con la finalidad de confirmar que el método de prueba del kit es reproducible en el laboratorio de control.
Cuando al método del kit se le realizan ajustes para optimizar la prueba, es necesario realizar ensayos de tolerancia o robustez, ejecutando la prueba en las condiciones normales de operación del kit así como incluyendo los cambios de optimización, con los cuales el resultado final no debe verse afectado.
Así en términos técnicos, se desarrolla la evaluación de tolerancia y/o robustez para determinar la capacidad del método de proporcionar resultados confiables mediante el análisis de la misma muestra bajo modificaciones externas al método (tolerancia) o pequeños cambios deliberados en las condiciones de operación del método (robustez).
Los parámetros evaluados durante la verificación del método de prueba, deben ser satisfactorios conforme a lo reportado por el fabricante del kit y conforme a las guías de verificación en las que se base el laboratorio de prueba para establecer los criterios de aceptación. Cuando los parámetros son satisfactorios se considera que el método de prueba del kit es apto para ser desarrollado y reproducido para la determinación a la que fue destinado.
Referencias Bibliográficas:
- Gonzalez Marcos M. I., Orden B., Pruebas de detección rápida para el diagnostico. Infecciones respiratorias, Revista Formación Activa en Pediría de Atención Primaria, 2009; 2 (4):220-224.
- Lazos Martinez R.J., Hernández Gutiérrez I., La validación de métodos: un enfoque práctico, Simposio de Metrología, 2004.
- Esmeralda del Sur M., Registro de kits de diagnostico contrastación, Food and Agriculture Organization of the United Nations, 2011.
- Organización Mundial de la Salud, Pruebas de diagnostico, 2018.
- Health Protection Agency. Commercial and in-house diagnostic tests: evaluations and validations. National Standard Method Quality Guidance (Q1) Issue 4.3
- Health Protection Agency. Guidance on the development and validation of diagnostic test that depend on nucleic acid amplification and detection, 2013.
- Burd M. Eileen. Validation of Laboratory-Developed Molecular Assays for infectious Diseases. Clinical Microbiology Review, July 2010, pp. 550-576.
- Jennings Lawrence, et al. Recommended principles and practices for validating clinical molecular pathology tests. Arch Pathol Lab Med. Vol 133, May 2009. Pág. 743-755.



 CONTROL DE CALIDAD
CONTROL DE CALIDAD ESTUDIOS ESPECIALIZADOS
ESTUDIOS ESPECIALIZADOS DIVTTma
DIVTTma PROTOCOLOS DE ESTABILIDAD
PROTOCOLOS DE ESTABILIDAD INVESTIGACIÓN Y DESARROLLO
INVESTIGACIÓN Y DESARROLLO SERVICIOS VETERINARIOS
SERVICIOS VETERINARIOS CURSOS Y EVENTOS
CURSOS Y EVENTOS MICROBIOLOGÍA
MICROBIOLOGÍA