Implementación de la metodología Oficial MGA 0612 en cuantificación de nitrosaminas en productos farmacéuticos
Las nitrosaminas son consideradas moléculas con potencial efecto cancerígeno debido al proceso metabólico que sufren en las células de mamíferos. Diversas organizaciones han emitido recomendaciones analíticas para su cuantificación, tal es el caso de FDA y EMA.

Ilustración 1. Equipo QTRAP 6500 utilizado para la determinación y cuantificación de nitrosaminas.
La Agencia Internacional para la Investigación de Cáncer (IARC) ha clasificado a las nitrosaminas como probable carcinogénico humano ya que se ha asociado en estudios preclínicos su efecto mutagénico con el desarrollo de cáncer colorrectal y cáncer gástrico. Su presencia se ha detectado en algunos productos farmacéuticos que son administrados por vía oral (por ejemplo, irbesartán, losartán, metformina y ranitidina) y que son expuestos al proceso metabólico del cuerpo, con lo que se marcó la pauta para generar un método de cuantificación.
Organizaciones como FDA y EMA han emitido recomendaciones analíticas para su cuantificación; en México, se desarrolló un método analítico, el 25 de febrero de 2022 entró en vigor la 13ª edición de la Farmacopea de los Estados Unidos Mexicanos (FEUM), en la cual se incluye el Método General de análisis (MGA) 0612 “Determinación de nitrosaminas en fármacos y preparados farmacéuticos” centrando su atención principalmente en “Sartanes” y por lo tanto, ya es considerada una prueba obligatoria para aquellos medicamentos que contengan metformina o bloqueadores del receptor de Angiotensina-2 (sartanes), como materia prima o producto terminado.
Cuantificación de Nitrosaminas
Establecer un método general para la cuantificación de nitrosaminas es complicado, ya que cada producto farmacéutico tiene un proceso diferente de fabricación, así como composición, sin embargo el MGA 0612, marca la oportunidad para una implementación y cuantificación de estas impurezas en muchos medicamentos, para ejemplificar, se muestra un diagrama (Figura 1) en donde observamos un camino general para comprender la ruta que se sigue cuando se busca cuantificar nitrosaminas en medicamentos y principios activos.
Revisemos el caso de un producto farmacéutico que contiene metfomina; como primer punto se recomienda realizar una investigación bibliográfica del principio activo o el preparado farmacéutico semejante en la literatura nacional e internacional, para confirmar si se tiene reporte de nitrosaminas, también se encomienda efectuar una investigación del ciclo de vida del producto para identificar las principales fuentes de formación de nitrosaminas y evaluar las posibles nitrosaminas. El siguiente paso, es ejecutar el método general de análisis, y verificar que el método de extracción es exacto y reproducible, este punto es crítico, ya que por lo regular cada producto farmacéutico tiene diversos excipientes y tiene un proceso de fabricación diferente, lo que obliga a realizar un método para cada producto ya que no siempre por lo mismo, es reproducible ni exacto.
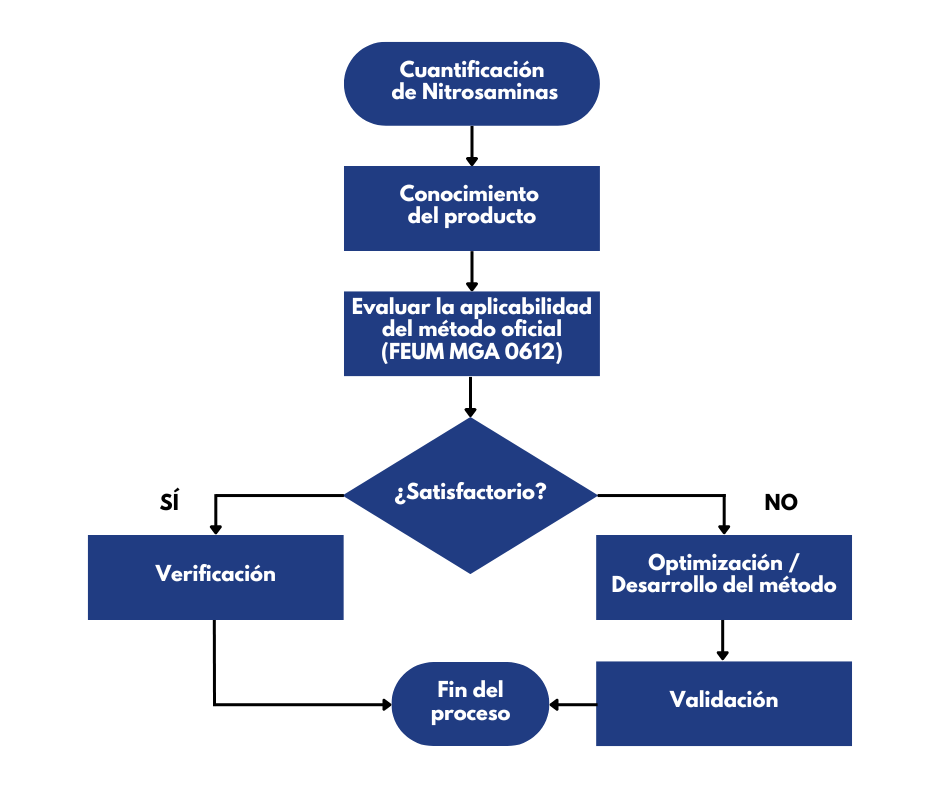
Fig 1. Diagrama de flujo para el desarrollo analítico de un método analítico para cuantificar nitrosaminas.
En los LEI, con el amplio compromiso con la industria farmacéutica que nos caracteriza y como apoyo a la autoridad sanitaria, surge la necesidad de implementar y validar el método para la determinación y cuantificación de nitrosaminas en productos farmacéuticos, en concordancia con lo establecido en el marco analítico nacional. En ese sentido se muestran los resultados al ejecutar el Método I del MGA 0612 en un Espectrómetro de masas triple cuadropolo (Exion LC 2.0 acoplado a QTRAP 6500+) (ver figura 2).
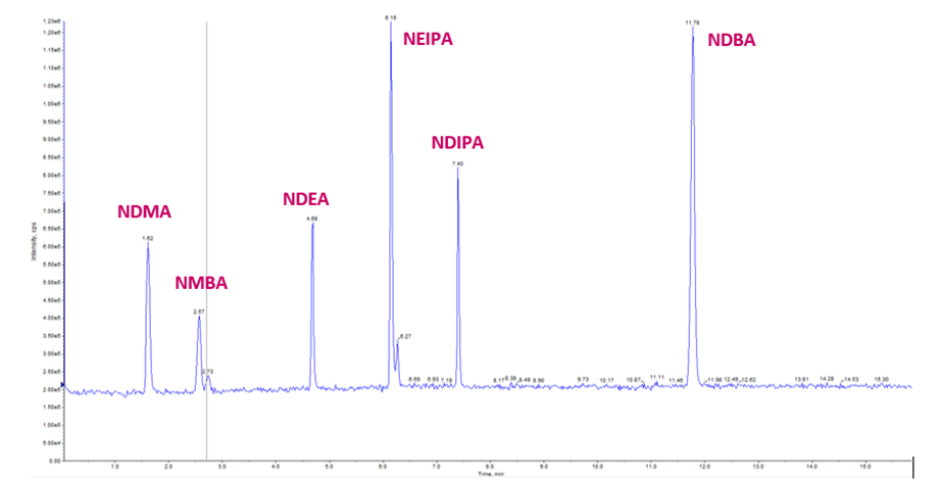
Fig 2. Se muestran las 6 nitrosaminas descritas en el MGA 0612 de la FEUM 13.0.
Bajo la experiencia adquirida al trabajar con múltiples productos farmacéuticos, el método analítico oficial es uno de los puntos de partida para la cuantificación de nitrosaminas, siempre y cuando el proceso de extracción sea estudiado y validado, sin embargo, no siempre es funcional lo descrito en el MGA, ya que en la mayoría de los medicamentos y principios activos, se presentan efectos de matriz que ocasionan una interferencia de señal, en la figura 3 se muestra el fenómeno descrito en un producto farmacéutico que contiene metfomina (de acuerdo con su monografía tiene como especificación 0.1 ppm de N-nitrosodimetilamina oNDMA y no más de 0.027 ppm de N-nitrosodietilamina o NDEA) , en este caso se muestra la supresión iónica del principio activo, el cual enmascara a los iones de las nitrosaminas NDEA y NDMA.
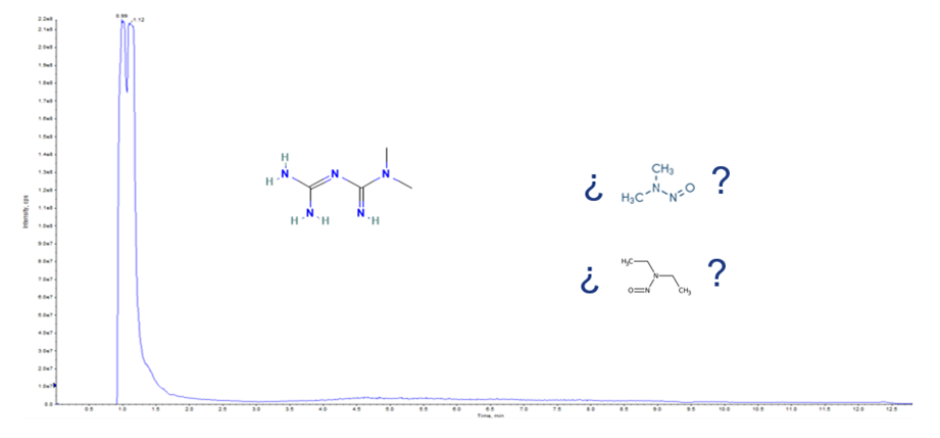
Fig 3. Efecto de matriz (supresión iónica) en un producto farmacéutico que contiene metformina.
De acuerdo con lo antes mencionado, el proceso de extracción es crucial en la metodología, y el mismo se debe optimizar, las estrategias para remediar el efecto de matriz se basan en las propiedades fisicoquímicas, entre ellas la solubilidad, puede ser empleando solventes de extracción considerando la solubilidad del principio activo, es decir probando diferentes solventes, por ejemplo metanol: agua, otra estrategia es utilizando un cosolvente para favorecer la precipitación y entre otras, también se emplea métodos de extracción en fase sólida.
Definida la extracción de las nitrosaminas en la muestra, es indispensable retar de nuevo el método analítico descrito en el MGA 0612 es decir, verificar el gradiente cromatográfico, así como los parámetros de operación del equipo de masas y demás parámetros del sistema permitan detectar las nitrosaminas en las muestras; una estrategia útil es preparar muestras adicionadas de las nitrosaminas de interés, y evaluar el porcentaje de recobro para cada una (ver fórmula), en la figura 4, se muestran los resultados de la optimización del método analítico, donde ya no se observa la supresión iónica.


Fig 4. Muestras adicionadas con estándares de nitrosaminas (NDEA y NDMA).
Cumplida la optimización del método, se procede a la validación o verificación (este tema se abordará en otra publicación), por lo que en este punto observa que a pesar de que el método oficial permite cuantificar las nitrosaminas, es indispensable retar el método de extracción con cada producto farmacéutico.
Si necesita este u otro servicio, contáctenos, podemos ayudarle.
Referencias:
- FEUM 13 ed. MGA 0612 Determinación de Nitrosaminas en Fármacos y Preparados y farmacéuticos . pp. 478.
- Joerg Schilingemann. Avoiding N-nitrosodimethylamine formation in metformin pharmaceuticals by limiting dimethylamine and nitrite. International Journal of Pharmaceutics Volume 620, 25 May 2022, 121740
- Organización Mundial de la Salud (2019, 20 de noviembre). ACTUALIZACIÓN SOBRE LAS IMPUREZAS DE NITROSAMINAS [Comunicado de prensa]. https://www.who.int/es/news/item/20-11-2019-information-note-nitrosamine-impurities.
- Prasannakumar B, Balamuralidhara V, Gowrav P, Venkatesh P. Nitrosamines in Drug Substance and Drug Product-A Regulatory Challenge. Int. J. Res. Pharm. Sci., 2020, pp. 2123-2130. DOI: 26452
- FDA. Liquid Chromatography-High Resolution Mass Spectrometry (LC-HRMS) Method for the Determination of Six Nitrosamine Impurities in ARB Drugs. Consultado en: https://www.fda.gov/media/125478/download.
- Extracción en fase sólida (SPE) (sigmaaldrich.com). https://www.sigmaaldrich.com/MX/es/applications/analytical-chemistry/sample-preparation/solid-phase-extraction



 CONTROL DE CALIDAD
CONTROL DE CALIDAD ESTUDIOS ESPECIALIZADOS
ESTUDIOS ESPECIALIZADOS DIVTTma
DIVTTma PROTOCOLOS DE ESTABILIDAD
PROTOCOLOS DE ESTABILIDAD INVESTIGACIÓN Y DESARROLLO
INVESTIGACIÓN Y DESARROLLO SERVICIOS VETERINARIOS
SERVICIOS VETERINARIOS CURSOS Y EVENTOS
CURSOS Y EVENTOS MICROBIOLOGÍA
MICROBIOLOGÍA

