La importancia de la detección de nitrosaminas en productos farmacéuticos
Por: D. en C. Melby Dessiré Mendoza Aguilar
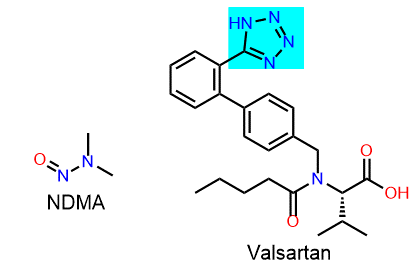
En 2018, las autoridades sanitarias reportaron por primera vez la presencia de la nitrosamina, N-nitrosodimetilamina (NDMA) en productos que contenían Valsartán. Meses después, se detectaron nitrosaminas en medicamentos de la misma familia, como irbesartán, losartán; así como en pioglitazona, ranitidina y metformina.
El descubrimiento de la presencia de nitrosaminas en algunos grupos de fármacos y medicamentos, produjo que las entidades regulatorias del mundo pusieran especial atención en su identificación y cuantificación, ya que, si bien por sí solas no tienen un efecto nocivo, al metabolizarse en el cuerpo pueden producir efectos mutagénicos y carcinogénicos.
En octubre de 2019, la Comisión Federal para la Protección Contra Riesgos Sanitarios (COFEPRIS) en su comunicado 017 sobre los productos que contienen en su formulación el principio activo, Ranitidina, informó que se encontraban evaluando los riesgos sanitarios a la salud en la población mexicana, por la posible presencia de la NDMA, ya que las concentraciones de esta nitrosamina por encima del límite considerado seguro y durante largos períodos de exposición, pueden incrementar el riesgo de desarrollar cáncer. Considerando este riesgo potencial, se volvió importante desarrollar una metodología analítica que permitiera la cuantificación de las posibles nitrosaminas presentes en fármacos y medicamentos.
Las agencias regulatorias de Estados Unidos y de la Unión Europea publicaron métodos para el análisis de nitrosaminas, utilizando la técnica de espectrometría de masas y la USP (Farmacopea de Estados Unidos) presentó un método de cuantificación.
El 25 de febrero de 2022 entró en vigor la 13ª edición de la Farmacopea de los Estados Unidos Mexicanos (FEUM), la cual incluye el Método General de Análisis (MGA) 0612 “Determinación de nitrosaminas en fármacos y preparados farmacéuticos”. Por lo que esta prueba, ahora resulta obligatoria en los medicamentos que contengan: pregabalina, gabapentina, metformina, losartán, irbesartán y ranitidina, ya sea como materia prima o producto terminado.
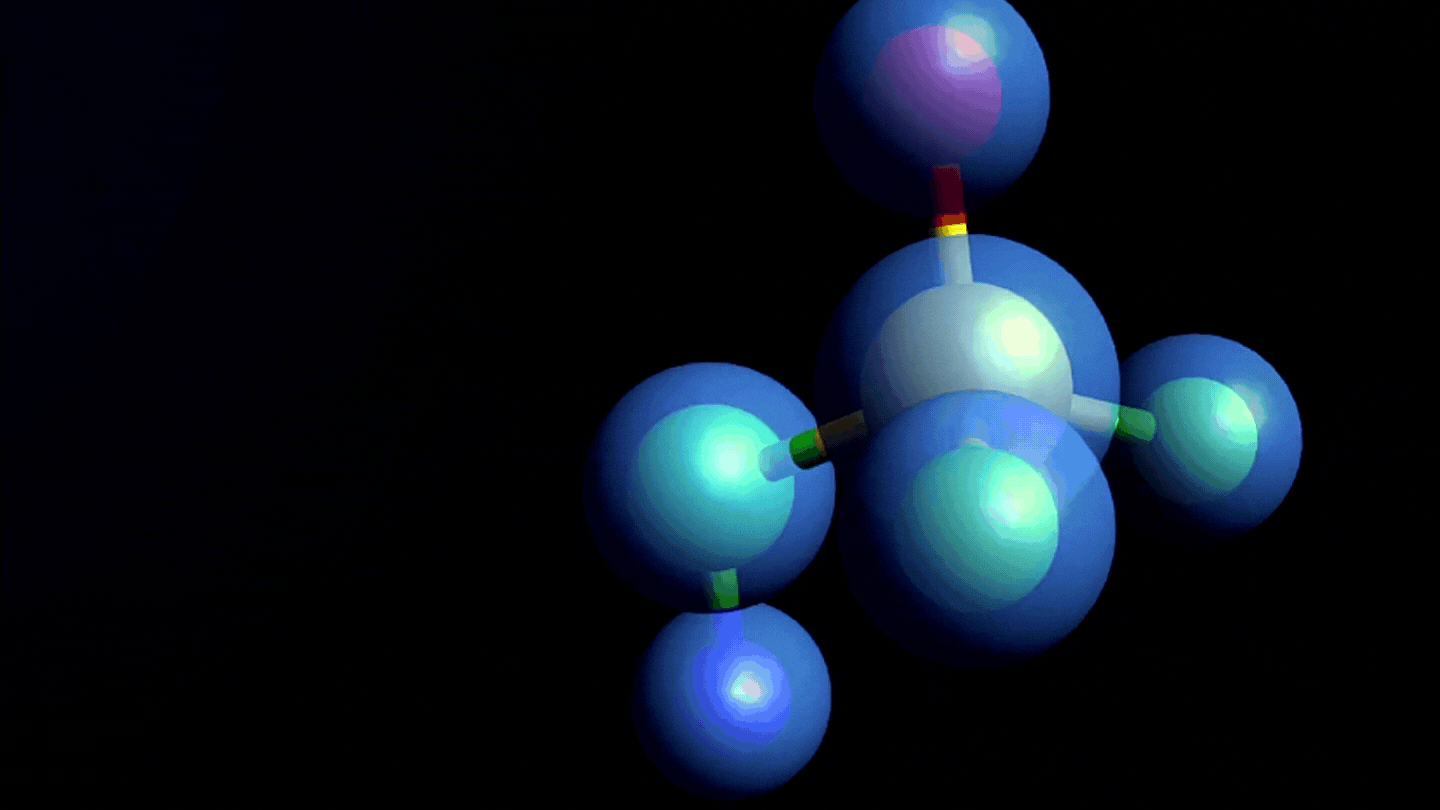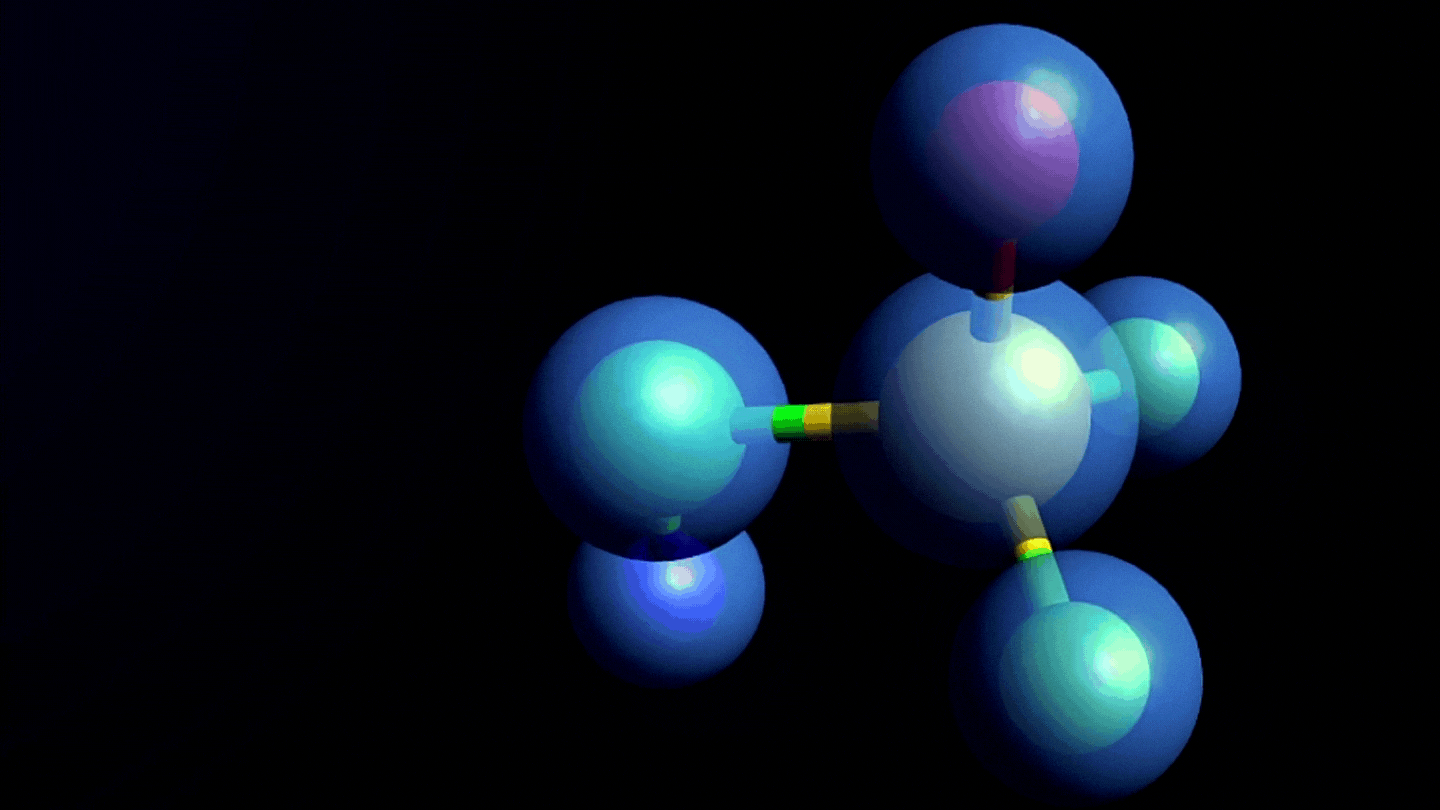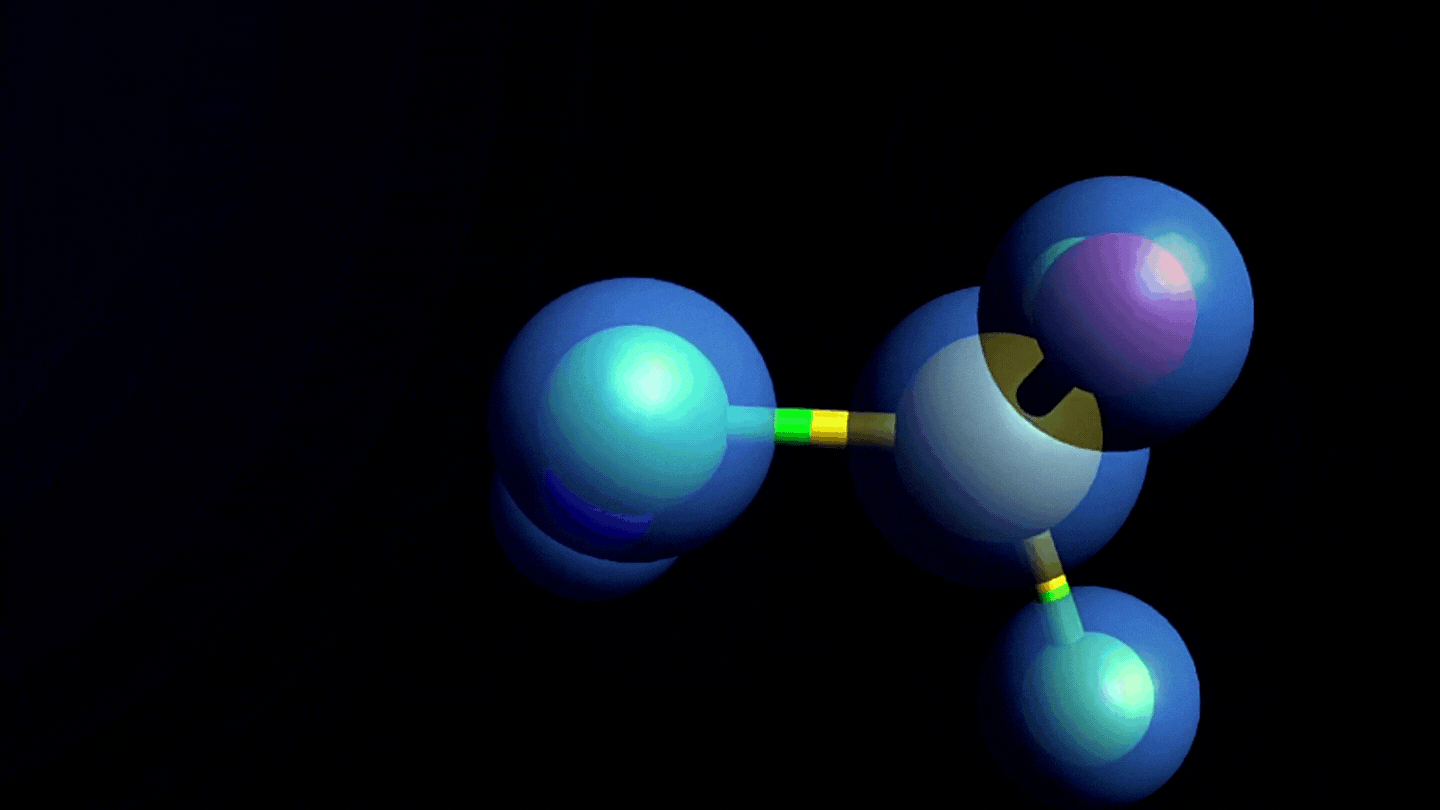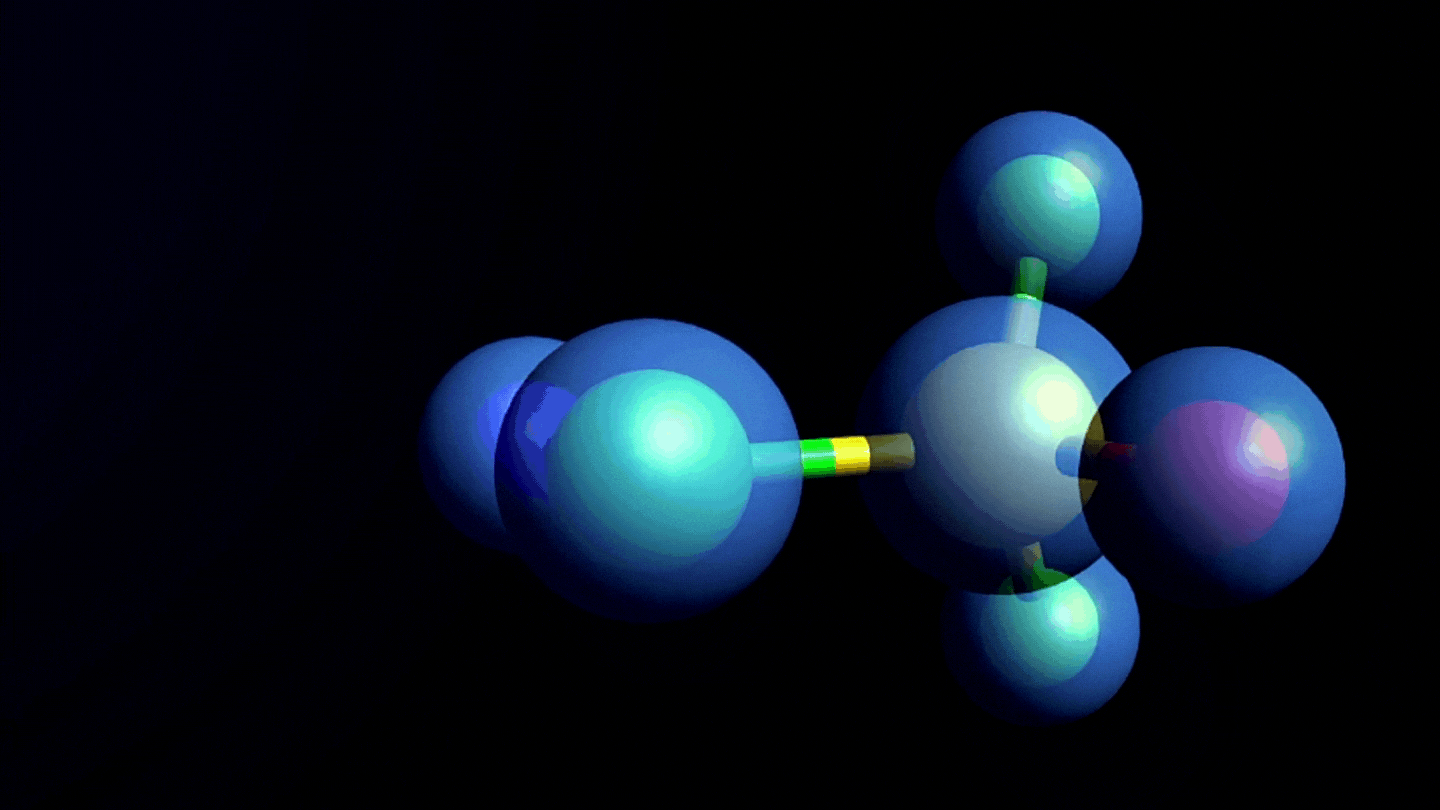
Estructura química y formación de las nitrosaminas
- Son un grupo de moléculas con potencial efecto cancerígeno, que en su estructura química tienen un grupo nitroso unido a una amina, de ahí el nombre de nitrosaminas.
- Las nitrosaminas se forman por reacción de aminas secundarias o terciarias (sustancias nitrosables) con un agente nitrosante en condiciones determinadas, por ejemplo, pH ácidos, altas temperaturas y/o presencia de agentes reductores.
¿Cuál es el riesgo sanitario del consumo de nitrosaminas?
Las nitrosaminas son compuestos orgánicos que no son tóxicas por sí mismas, pero que en las células de mamíferos sufren un proceso metabólico que conduce a la formación de sales de diazonio, las cuales son altamente reactivas con el material genético.
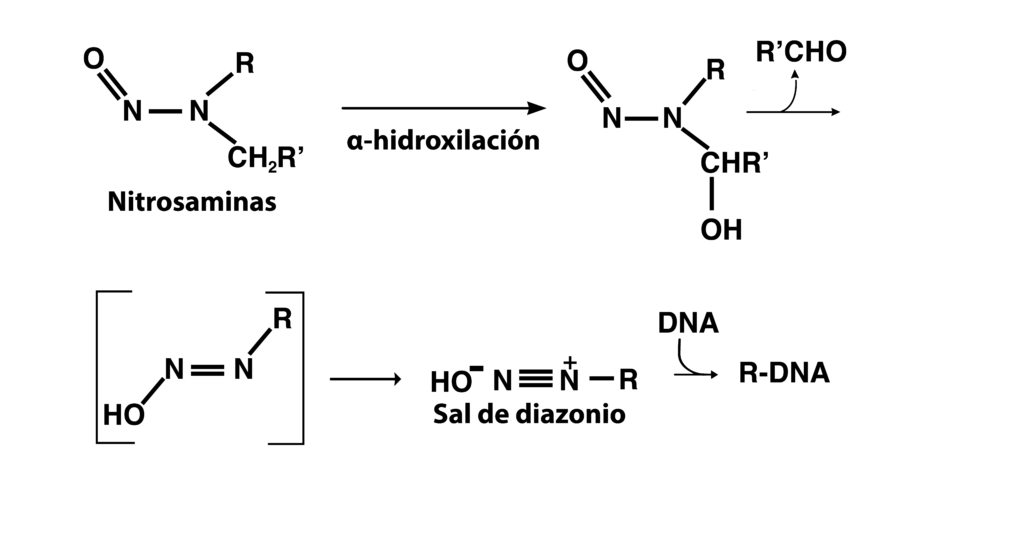
El metabolismo hepático incluye reacciones biológicas de oxidación, las cuales ocasionan que las nitrosaminas sean hidroxiladas en la posición alfa. Así, los grupos alquílicos hidroxilados pueden ser eliminados en forma de alcohol a través de una heterólisis. El intermediario resultante se deshidrata y forma los iones alquil diazonio; los cuales son electrofílicos.
En el cuerpo humano, tenemos compuestos de carácter nucleofílico, como son los aminoácidos, proteínas y las bases nitrogenadas del ADN. El ión alquil diazonio, es susceptible de sufrir una reacción de sustitución nucleofílica tipo SN2, en donde el agente nucleofílico es una base nitrogenada del ADN, ejemplo: la guanina que tiene heteroátomos en su estructura química, con pares de electrones libres, como lo son el nitrógeno y el oxígeno.
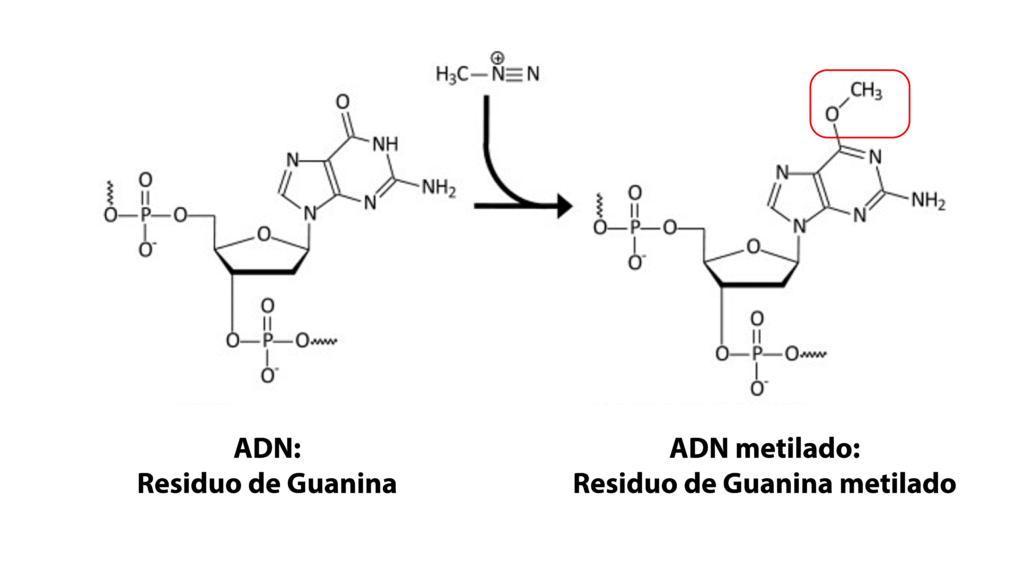
Este tipo de reacciones de alquilación, producen como resultado una base nitrogenada alquilada; en este caso, una guanina metilada. En estudios preclínicos, se ha asociado el efecto mutagénico, con el desarrollo de cáncer colorrectal y cáncer gástrico. Por lo que las nitrosaminas son clasificadas por la Agencia Internacional para la Investigación del Cáncer (IARC) como probables carcinógenos humanos.

Principales fuentes de formación de nitrosaminas
El MGA 0612 de la FEUM, indica que se debe realizar un análisis de riesgo de la presencia de nitrosaminas en el fármaco y el preparado farmacéutico, así como las fuentes de formación de las mismas. Las principales fuentes de formación de nitrosaminas que se han identificado son:
- Durante la síntesis del principio activo, donde se vea involucrado un grupo amino y ácido nítrico o sales de nitritos.
- En la adición de azida de sodio como conservador en materias primas a granel.
- Durante procesos de acondicionamiento con materiales plásticos termo-modelados, donde el calor generado y el contacto del medicamento con el empaque primario pueda generar la interacción fármaco-polímero.
- En el reciclaje de disolventes durante la purificación, que se hayan contaminado previamente; así como reciclar catalizadores.
- Solventes orgánicos contaminados.
- Degradación del principio activo, o interacción con el envase primario.
- Excipientes.
Límites permitidos de Nitrosaminas
Aunque existen muchas nitrosaminas, el MGA 0612 de la FEUM, menciona seis de ellas, así como los límites de ingesta aceptables por día:
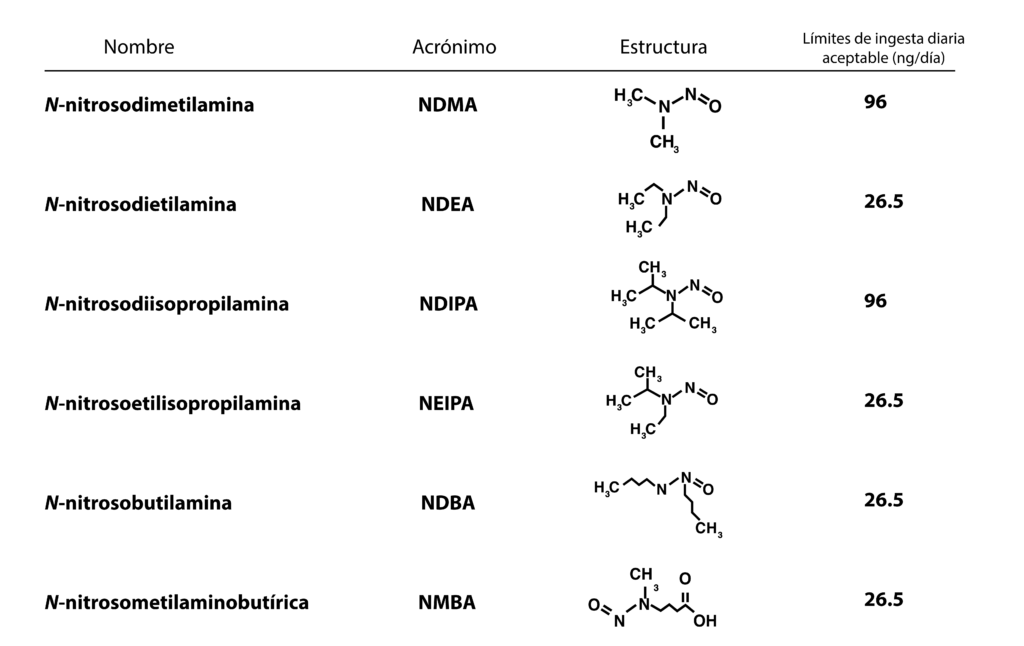
Los límites permitidos de nitrosaminas se encuentran en la monografía de cada fármaco y preparado farmacéutico, la especificación está basada en la ingesta diaria permitida, de acuerdo con el esquema terapéutico de cada medicamento.
Métodos analíticos para la detección y cuantificación de nitrosaminas
Entre la diversidad de técnicas analíticas con las que contamos en los Laboratorios de Especialidades Inmunológicas (LEI), la cromatografía de líquidos de alta resolución acoplada a espectrometría de masas triple cuadrupolo posee una alta sensibilidad que nos permite identificar y cuantificar compuestos en concentraciones de ng/mL.
Las condiciones descritas en la FEUM sirven como base para optimizar el proceso en cada laboratorio, de tal forma que se implemente una metodología analítica para cada producto de interés. Es decir, dependiendo de las muestras que se manejan o incluso si se trata de materia prima o producto terminado, se deberá realizar la validación del método analítico considerando la variabilidad que existe en el uso de excipientes, materiales de empaque, etc.
El punto anterior cobra mayor relevancia en la preparación de la muestra, lo cual se convierte en un tema crítico, debido también a las bajas concentraciones de nitrosaminas que se pretenden determinar, ya que el propósito es evitar la pérdida de estas impurezas o de alguna manera generar las nitrosaminas como parte de la misma técnica analítica.
En la estrategia generada para la validación del método analítico juega un papel relevante el definir el límite de detección y límite de cuantificación para las nitrosaminas a evaluar, y determinar si estos valores efectivamente se encuentran por debajo de la especificación que se tiene para cada fármaco o producto terminado.

Se recomienda que las características de desempeño del método que necesitan ser evaluadas para el análisis cuantitativo de nitrosaminas incluyan la verificación de la adecuabilidad del sistema, linealidad del sistema (en un rango de 0,5 a 25 ng/mL), especificidad, exactitud, repetibilidad, precisión intermedia, límite de cuantificación y límite de detección. La precisión y recuperación dependen en gran medida de la concentración y la complejidad de la matriz, los criterios de aceptación finales propuestos necesitan estar justificados en la documentación de validación del procedimiento. Estos parámetros de desempeño deberán caracterizar el efecto de matriz que puede llegar a presentarse o comprobar que este efecto no existe.
Experiencia en Determinación de Nitrosaminas en los LEI
En los Laboratorios de Especialidades Inmunológicas hemos trabajado en el desarrollo de métodos para la cuantificación de nitrosaminas en materia prima y producto terminado, desde hace un par de años.
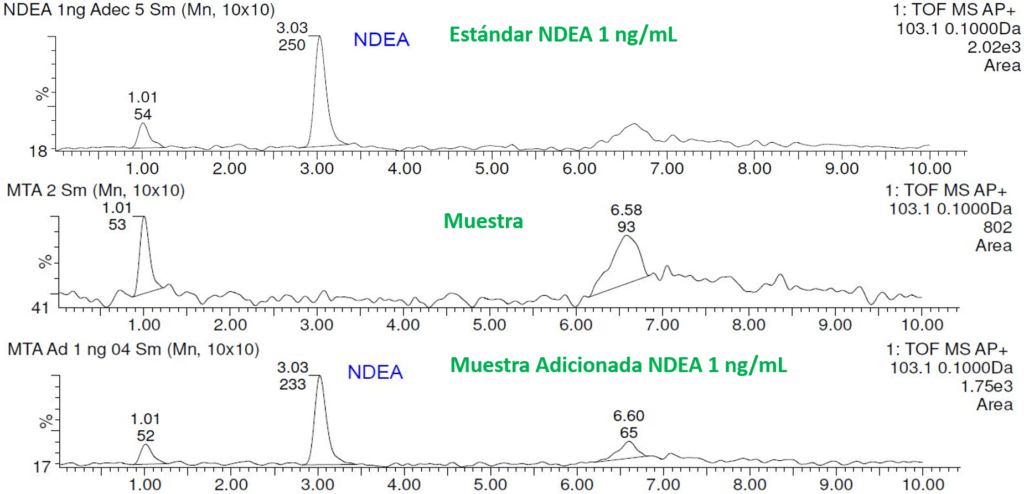
Desarrollamos y validamos un método para la cuantificación de la N-nitrosodietilamina (NDEA), en materia prima de pregabalina, utilizando un UPLC-MS QToF. Equipo en el cual se realizaron los análisis iniciales para la determinación de nitrosaminas, por las agencias regulatorias alrededor del mundo. Migrando después a la tecnología de triple cuadrupolo para enfocarse en la sensibilidad de la detección. En el desarrollo de esta metodología se presentaron problemas de supresión iónica por parte del principio activo (API), que enmascaraba la señal de la NDEA consiguiendo porcentajes de recuperación menores al 1% con los métodos de extracción descritos en el MGA 0612. Por lo que desarrollamos una metodología para la purificación de la muestra, la cual nos permitió alcanzar porcentajes de recuperación mayores al 90 % evaluando muestras adicionadas del API contra el estándar preparado a la misma concentración, obteniendo durante la validación un límite de cuantificación de 0,3179 ng/mL y un límite de detección de 0,0953 ng/mL.



 CONTROL DE CALIDAD
CONTROL DE CALIDAD ESTUDIOS ESPECIALIZADOS
ESTUDIOS ESPECIALIZADOS DIVTTma
DIVTTma PROTOCOLOS DE ESTABILIDAD
PROTOCOLOS DE ESTABILIDAD INVESTIGACIÓN Y DESARROLLO
INVESTIGACIÓN Y DESARROLLO SERVICIOS VETERINARIOS
SERVICIOS VETERINARIOS CURSOS Y EVENTOS
CURSOS Y EVENTOS MICROBIOLOGÍA
MICROBIOLOGÍA